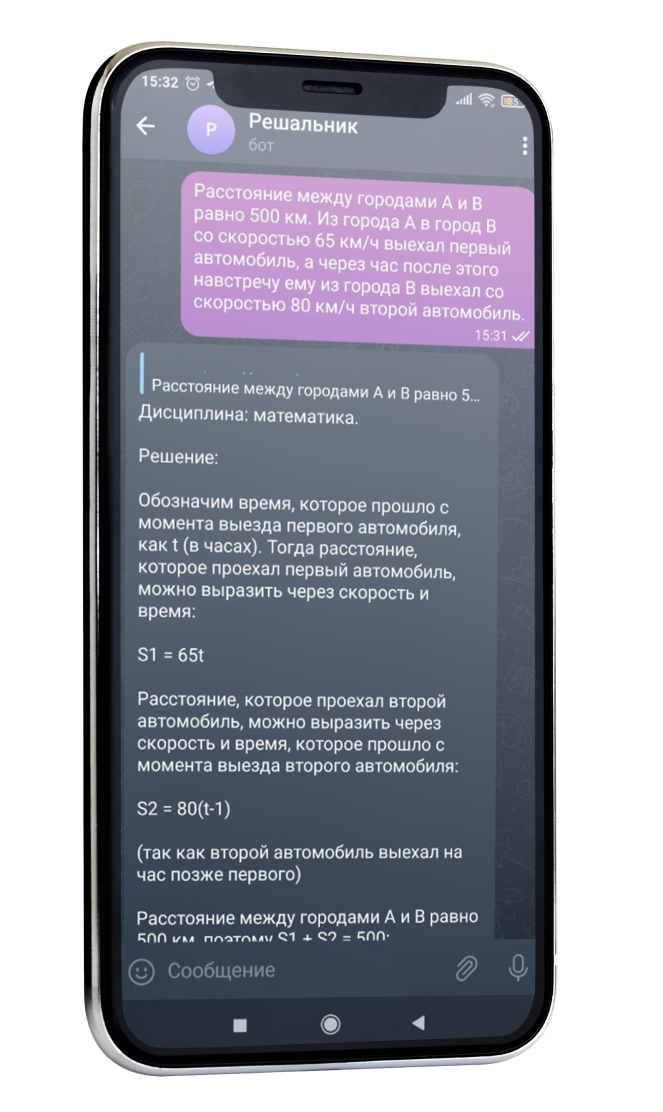
Определите массу воздуха в классе размером 6x8x3 м при температуре 20 °С и нормальном атмосферном давлении. Молярную массу воздуха примите равной 0,029 кг/моль
Решение
Уравнение идеального газа:
PV = nRT
где P - давление (Па), V - объем (м³), n - количество вещества (моль), R - универсальная газовая постоянная (8.314 Дж/(моль·К)), T - температура (К).
Сначала переведем температуру из °C в Кельвины:
T = 20 °C + 273.15 = 293.15 K
Нормальное атмосферное давление составляет 101325 Па.
Объем класса можно найти по формуле V = a × b × h, где a, b и h - размеры класса:
V = 6 м × 8 м × 3 м = 144 м³
Теперь найдем количество вещества (n) воздуха в классе:
n = PV / RT = (101325 Па × 144 м³) / (8.314 Дж/(моль·К) × 293.15 K) ≈ 5956.8 моль
Теперь можно найти массу воздуха (m), используя молярную массу воздуха (M) равной 0.029 кг/моль:
m = n × M = 5956.8 моль × 0.029 кг/моль ≈ 172.7 кг
Масса воздуха в классе размером 6x8x3 м при температуре 20 °C и нормальном атмосферном давлении составляет примерно 172.7 кг.
PV = nRT
где P - давление (Па), V - объем (м³), n - количество вещества (моль), R - универсальная газовая постоянная (8.314 Дж/(моль·К)), T - температура (К).
Сначала переведем температуру из °C в Кельвины:
T = 20 °C + 273.15 = 293.15 K
Нормальное атмосферное давление составляет 101325 Па.
Объем класса можно найти по формуле V = a × b × h, где a, b и h - размеры класса:
V = 6 м × 8 м × 3 м = 144 м³
Теперь найдем количество вещества (n) воздуха в классе:
n = PV / RT = (101325 Па × 144 м³) / (8.314 Дж/(моль·К) × 293.15 K) ≈ 5956.8 моль
Теперь можно найти массу воздуха (m), используя молярную массу воздуха (M) равной 0.029 кг/моль:
m = n × M = 5956.8 моль × 0.029 кг/моль ≈ 172.7 кг
Масса воздуха в классе размером 6x8x3 м при температуре 20 °C и нормальном атмосферном давлении составляет примерно 172.7 кг.
Нужно решить другие задачи?


Как пользоваться ботом
Напиши боту интересующий вопрос по физике
01

Получи ответ!
02


Бот решает задачи по всем специальностям







Школьная программа
Иностранный язык




Информатика










ЕГЭ
Иностранный язык




Информатика






Социология
Психология




Гуманитарные специальности
Иностранный язык
Языкознание




Педагогика
Философия
Информатика






Финансы
Менеджмент
Статистика
Банковское дело




Экономические специальности
Иностранный язык
Бух. учет
Маркетинг




Психология
Экономика
Информатика






Шрифты
Дизайн
Конструкции
Механика




Медиа, дизайн, архитектура
Типографика
Материаловедение
Сопромат




Комп. технологии
Графика
Информатика



Примеры решенных задач по физике
Оставь рутину боту!
Наш телеграмм бот разработан на базе передовых технологий искусственного интеллекта, что позволяет ему быстро и точно решать широкий спектр задач, связанных с математикой, физикой, химией, биологией и другими науками.
Бот также способен оказывать помощь в выполнении домашних заданий, подготовке к экзаменам и олимпиадам.
Решенные задачи по физике
Решенные задачи по физике демонстрируют мощь телеграмм-бота, разработанного с использованием передовых технологий искусственного интеллекта.
Основные преимущества нашего телеграмм бота:
Быстрота и точность решений
Получайте ответы на ваши вопросы в режиме реального времени.
01
Доступность
Наш бот доступен 24/7, что обеспечивает ученикам возможность получить помощь в любое время суток.
02
Простота использования
Интуитивно понятный интерфейс позволяет легко взаимодействовать с ботом даже самым младшим пользователям.
03
Отзывы
Учусь на технической специальности. Очень помогает в сопромате и остальных предметах!
Игорь
Готовлюсь к ЕГЭ вместе с Решальником. Может объяснить задачи, которые вводят в ступор даже нашего учителя.
Мария
Оплатила сыну подписку сразу на 6 месяцев. Теперь даже не проверяю его уроки.
Анна
Делаю с ним все домашки и не парюсь. Теперь стало больше свободного времени по вечерам.
Андрей
Часто генерирую доклады с помощью Reshalnik AI. Как будто у вас там человек их пишет)) Всегда идеальные
Мария













